Electronegatividad
¿Que es electronegatividad?
La electronegatividad es una medida de la capacidad de un átomo (o de manera menos frecuente de un grupo funcional) para atraer a los electrones, cuando forma un enlace químico en una molécula.
Su valor se realiza a partir de una escala. La escala que más se utiliza es la de Pauling, en la que, de forma arbitraria, el F tiene EN 4,0 y el Cs 0,7.
Ésta es la propiedad relevante en relación con la capacidad de combinación de los átomos y el tipo de enlace que forman.
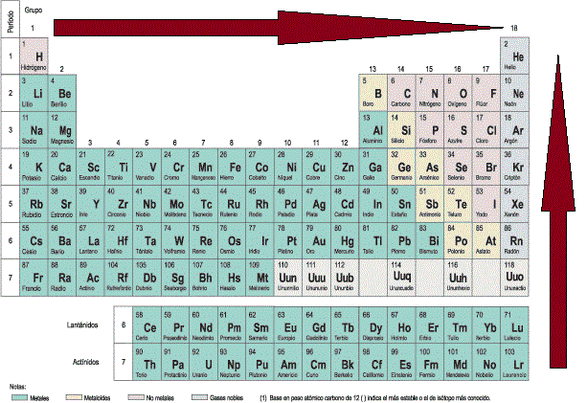
Fíjate en la imagen para deducir cómo evoluciona la EN. El color rojo indica valores altos de la propiedad, y el amarillo valores bajos. El color gris indica que no hay datos: como los gases nobles no forman enlaces, no se puede determinar EN para ellos. [4]

Electropositividad
¿Que es electropisitividad?
-
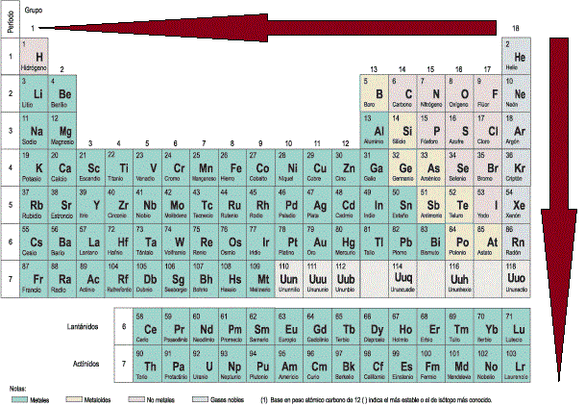
Electropositividad: La electropositividad es lo contrario a la electronegatividad es decir, es la capacidad de un elemento de ceder electrones o densidad electrónica y por lo tanto, crece en direcciones contrarias a su opuesto, es decir, aumenta al bajar por un grupo y disminuye al avanzar en un período. Si bien, mirando la tabla periódica en la parte inferior se muestran las direcciones de crecimiento de la electropositividad en la Tabla Periódica. se diría que el Francio (Fr) es el elemento más electropositivo, se considera por lo general al Cesio (Cs) como tal, debido a que el Francio es radiactivo y se descompone fácilmente en otros elementos. [4]
Energia de Ionizacion
¿Que es la energia de ionizacion?
La energía de ionización (EI) es la energía que hay que suministrar a un átomo neutro, gaseoso y en estado fundamental para arrancarle el electrón más externo, que está más débilmente retenido, y convertirlo en un catión monopositivo gaseoso.
Se puede expresar así: A(g) + EI → A+(g) + e-
La energía de ionización es igual en valor absoluto a la energía con que el núcleo atómico mantiene unido al electrón: es la energía necesaria para ionizar al átomo.
Al ser la energía de ionización una medida cuantitativa de la energía de unión del electrón al átomo, la variación de esta magnitud ayuda a comprender las diferencias cualitativas entre estructura electrónicas.
La magnitud de la energía de ionización depende de tres factores fundamentales: estructura electrónica de la última capa, radio atómico y carga nuclear. El factor determinante es la configuración electrónica de la última capa, puesto que cuanto mas estable sea, es decir cuanto más se parezca a la de estructura completa, estructura de gas noble, mayor energía será necesaria para arrancar un electrón. [4]